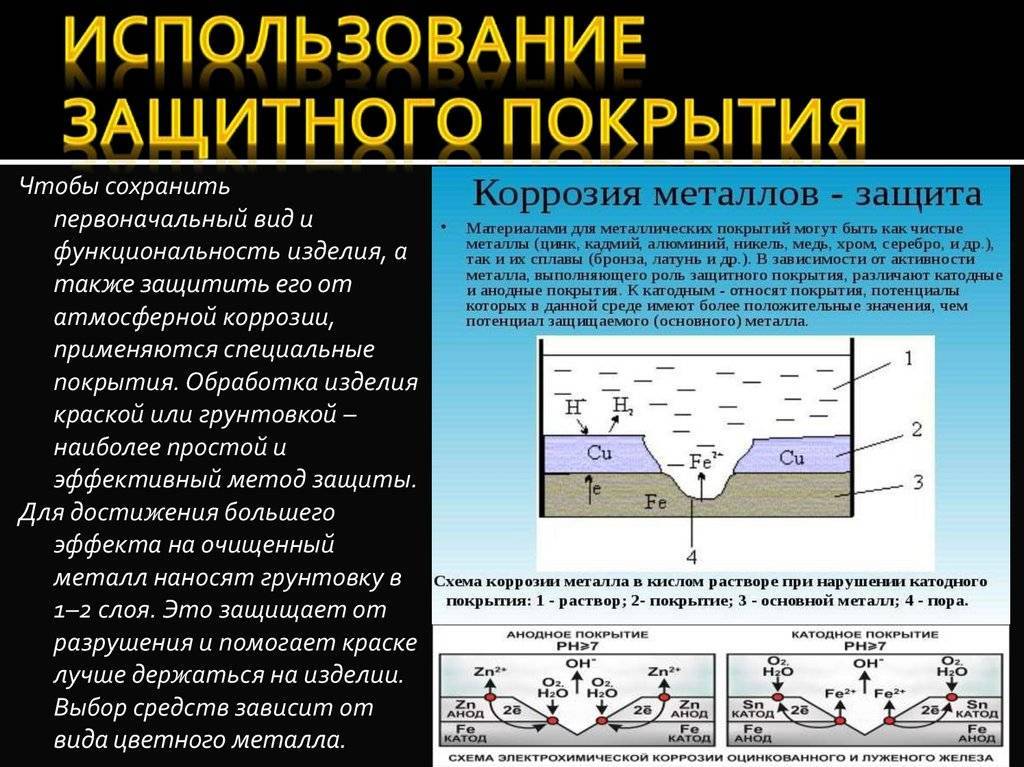
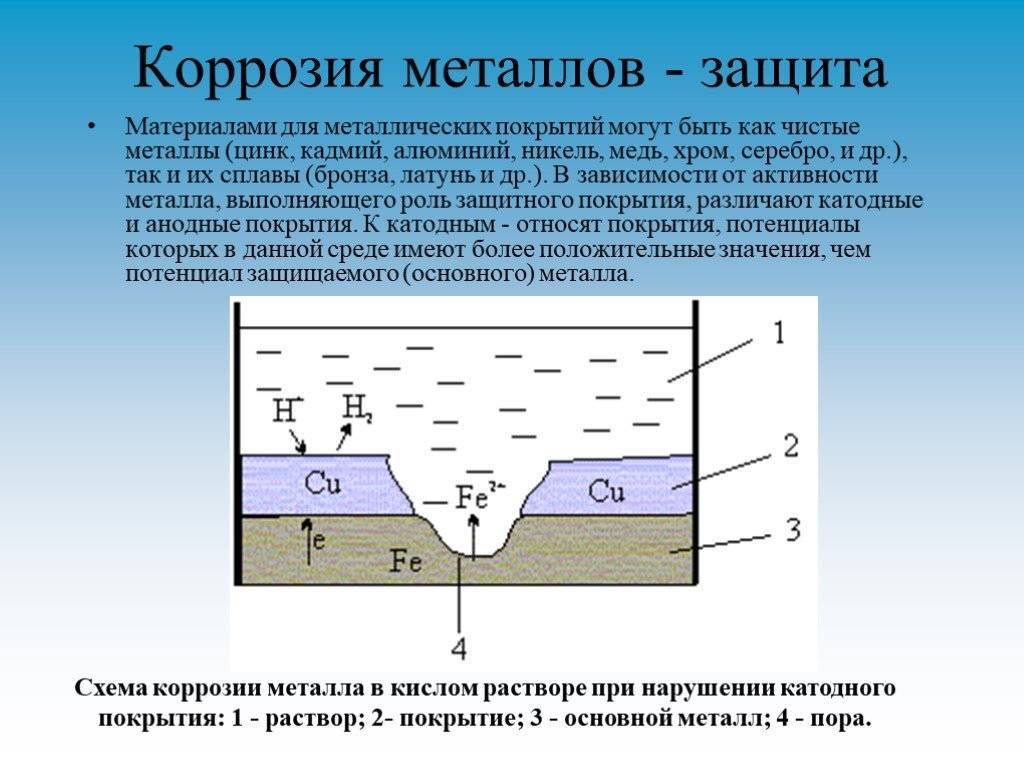
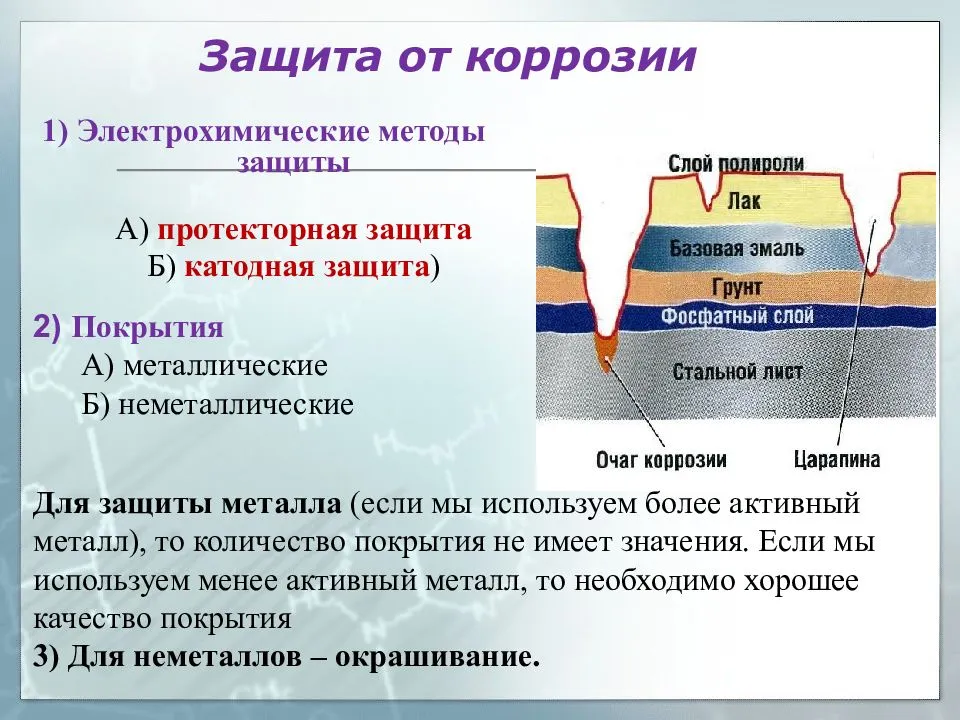
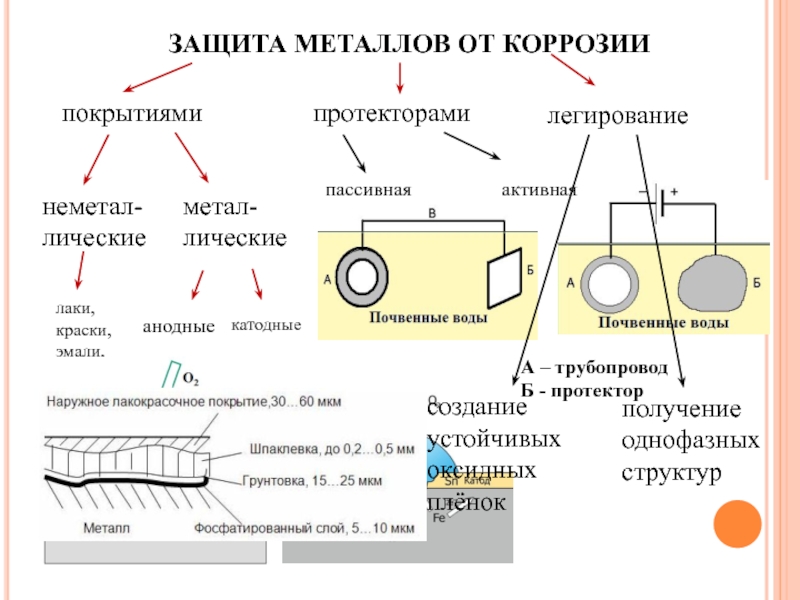
Физические и химические параметры элемента
- Кристаллизация химического элемента происходит в кубической гранецентрированной решетке. Металл может окисляться при комнатной температуре. При этом его поверхность покрывается тонкой оксидной пленкой, выполняющей защитную функцию.
- Температура плавления химически чистого алюминия 660 °C, кипения — 2450 °C. Плотность металла при нормальных условиях составляет 2,6989 г/см3.
- На воздухе алюминий окисляется с образованием тонкой пленки, которая препятствует дальнейшему реагированию с металлом. Такое защитное соединение формируется, если поместить алюминий в концентрат азотной кислоты.
- Металл активно взаимодействует с соляной кислотой. При реакции со щелочами сначала разрушается защитный оксидированный слой, а затем происходит реакция с образованием алюминатов натрия, калия (в зависимости от вида щелочного соединения).
- При нагревании химический элемент реагирует с бромом и хлором. При взаимодействии с серой образуется сульфид алюминия, который легко растворяется в воде. С водородом металл реагирует косвенно путем искусственного синтеза органических соединений. В результате образуется сильнейший восстановитель — полимерный гидрид алюминия.
- При сжигании порошкообразного металла на воздухе образуется тугоплавкий порошок оксида химического элемента, соединение которого обладает высокой прочностью. Это свойство используется для восстановления металлов из их окислов.
- В лабораторных условиях соединения алюминия, содержащие гидроксильную группу OH, можно получить в результате обменных реакций или за счет добавления в раствор соды или аммиака. Соединение алюминия оседает на дно в виде гелеобразного осадка.
Защита от огня
Алюминий и его сплавы с магнием в компактной форме, в частности в виде строительных профилей, ни в твердом, ни в расплавленном состоянии не горят, не поддерживают горения и не способствуют распространению пламени. Это обусловлено наличием на алюминии поверхностной окисной пленки, которая огнеупорна, и тем, что ввиду высокой теплопроводности алюминия теплота с поверхности быстро “оттягивается” в толщу металла.
Примечание. Все более частой причиной пожаров в настоящее время становятся намеренные поджоги с предварительным выводом из строя извещателей пожарной сигнализации и систем активного автоматического пожаротушения. Поэтому все более значимую роль начинают играть средства пассивной защиты.
Однако это же “оттягивание” теплоты приводит к быстрому нагреванию алюминиевых конструкций до температуры 200 – 250 градусов Цельсия, при которой они начинают терять прочность, что может привести к катастрофическим последствиям.
Одним из средств пассивной защиты от огня является окрашивание опорных конструкций здания, ограждений интумесцентными ЛКМ. Эти материалы образуют лакокрасочные ПК, которые способны вспучиваться под воздействием высоких температур или при контакте с пламенем и увеличиваться в объеме в десятки раз, создавая негорючую пену с низкой теплопроводностью, что препятствует слишком быстрому нагреванию подложки. Пена (другое название – пенококс), которая образуется при этом, должна быть не только негорючей и иметь низкую теплопроводность, но и удерживаться на подложке в течение заданного времени. В России ЛКМ, удовлетворяющие данным требованиям, называют чаще не интумесцентными, а вспучивающимися красками (ВК), хотя ясно, что вспучивание – свойство ПК, а не краски.
Эти краски, в отличие от других средств пассивной защиты – асбестоцементных обмазок, вермикулитовых плит, не утяжеляют конструкцию. Наиболее часто используемые ныне ВК изготавливают из таких основных компонентов, как полимерный пленкообразователь, полифосфат аммония, обусловливающий вспенивание, негорючесть и прочность пены, пентаэритрит, также активно участвующий в образовании пенококса, меламин, роль которого заключена в сочетании способностей к интенсивному газовыделению и к укреплению образующегося пенококса.
В качестве компонента, обеспечивающего вспучивание при нагревании, недавно начали использовать так называемые интеркалированные соединения графита (ИСГ). Под действием огня или беспламенного теплового удара ПК, содержащие ИСГ, начинают вспучиваться уже при 120 градусах Цельсия, причем их объем увеличивается в десятки раз. Из ИСГ образуется негорючая пена с низкой теплопроводностью, высокой термической стойкостью.
Наряду с этими компонентами в рецептуры ВК могут быть введены ингибиторы, поверхностно-активные вещества, наполнители, пигменты, другие функциональные добавки.
Интумесцентные ЛКМ можно считать выдающимся достижением науки и техники в деле борьбы с пожарами, а традиционные ЛКМ, образующие лишь негорючие покрытия, следует считать “уходящими со сцены”, поскольку они не защищают конструкцию от нагревания до критической температуры.
Примером такой ВК может быть “Файрекс-200”, образующий ПК, вспучивание которого начинается при температуре 120 градусов Цельсия. Несколько ВК разработано для защиты от пожара алюминиевых конструкций в самолетах. ПК из них начинают вспучиваться при температуре 180 градусов Цельсия.
В.А.Войтович
Доцент
Нижегородского архитектурно-
строительного университета
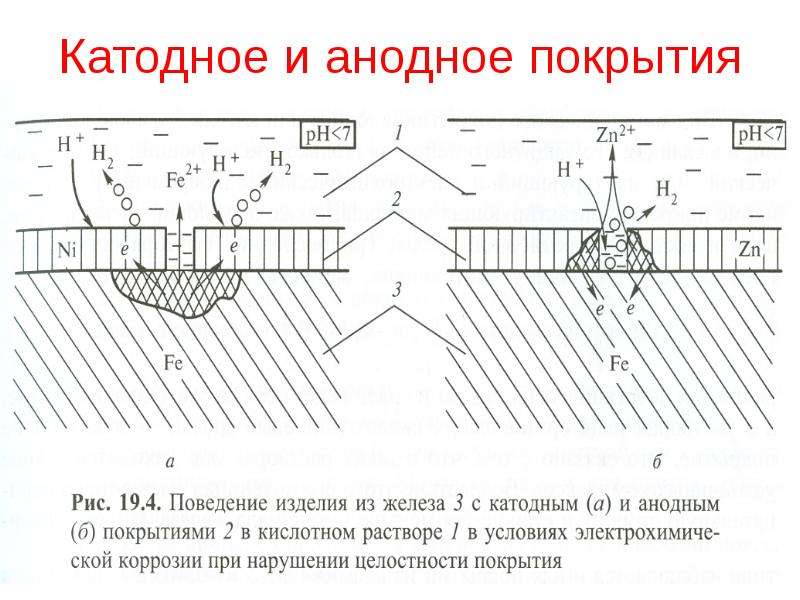
Причины и признаки электрохимической коррозии
Электрохимическая коррозия отличается от химической тем, что процесс разрушения проходит в системе электролитов, отчего внутри этой системы возникает электрический ток. Два сопряжённых процесса, анодный и катодный, приводят к удалению из кристаллической решетки металла неустойчивых атомов. Ионы при анодном переходят в раствор, а электроны от анодного процесса попадают в ловушку к веществу-окислителю и связываются деполяризатором.
Таким образом, деполяризация – это отвод с катодных участков свободных электронов, а деполяризатор – вещество, которое отвечает за этот процесс. Основные реакции происходят с участием водорода и кислорода в роли деполяризаторов.

Существует множество примеров электрохимической коррозии разного типа, которая оказывает воздействие на металлические поверхности в природе и проходит под влиянием различных условий. Водород при этом работает в кислой среде, а кислород – в нейтральной.
Практически все металлы подвергаются электрохимической коррозии, и по этому признаку их разбивают на 4 группы, определяют величину их электродного потенциала:
- активные коррозируют даже в той среде, где нет окислителей;
- среднеактивные вступают в реакцию окисления в кислотной среде;
- малоактивные не вступают в реакцию при отсутствии окислителей и в нейтральных, и в кислых средах;
- не вступают в реакцию — высокой стабильности (благородные металлы, палладий, золото, платина, иридий).

Но эта же реакция может протекать и в воде, в растворах оснований, солей и кислот. В узкоспециальном различии атмосферной коррозии различают почвенную и аэрационную, морскую и биологическую (протекающую под воздействием бактерий).
Есть даже электрическая коррозия, которая протекает под воздействием электрического тока, и является результатом работы блуждающих токов, возникающих там, где электрический ток используется человеком для осуществления определенной деятельности.
Гомогенная металлическая поверхность при этом разрушается из-за термодинамической неустойчивости к окружающей среде. А гетерогенная – из-за состава кристаллической решётки, в которой атомы одного металла держатся плотнее, чем атомы инородных вкраплений. Эти реакции отличаются скоростью протекания ионизации ионов, и восстановления окислительных компонентов окружающей среды.
Разрушение металлических поверхностей при электрохимической коррозии состоит в одновременном протекании двух процессов: анодного и катодного, и отличия процессов состоят в том, что растворение происходит на анодах, которые и контактируют с окружающей средой через множество микроэлектродов, которые входят в состав поверхности любого металла и замкнуты на себя.

Неорганические соединения
Алюминий не стоек к действию кислот. Исключение составляют концентрированные азотная и серная кислоты — их окислительные свойства настолько сильны, что при контакте с алюминием на его поверхности образуется прочный слой оксида алюминия, препятствующий дальнейшему разрушению металла (поэтому концентрированную азотную или серную кислоту перевозят в алюминиевых цистернах). Разбавленная азотная или серная кислота — более слабый окислитель — энергично реагирует с алюминием.
В кислотах алюминий растворяется тем хуже, чем меньше содержит дополнительных примесей. Следует помнить, что анодное окисление не защищает от воздействия кислот, поскольку они разрушают слой Al2O3. Химическая активность кислот увеличивается с ростом температуры. Например, с возрастанием температуры на 10°С скорость коррозии удваивается. Увеличение концентрации кислоты, как правило, увеличивает скорость коррозии (концентрированные серная и азотная кислоты — исключение).
Соляная кислота вызывает сильную коррозию. Действие этой кислоты нельзя ослабить добавлением ингибиторов.
Фтороводородная кислота оказывает самое сильное влияние на алюминий. Даже непродолжительное взаимодействие разбавленной кислоты ведет к полному растворению алюминия.
Кислородсодержащие кислоты хлора (HClO4, HClO3, HClO) вызывают сильную коррозию алюминия.
Серная кислота вызывает равномерную коррозию алюминия, интенсивность которой зависит от концентрации. Разбавленная кислота средней концентрации при комнатной температуре отличается умеренной агрессивностью. Наиболее агрессивна кислота концентрации 80%. Некоторые вещества, входящие в состав алюминиевых сплавов, а также ионы, содержащиеся в воде (особенно фториды и хлориды), усиливают действие серной кислоты.
Сернистая кислота вызывает локальную коррозию алюминия.
Сера и халькогены (селен и теллур) на алюминий не действуют.
Фосфорная кислота разрушает алюминий умеренно или сильно (в зависимости от концентрации).
Мышьяк при комнатной температуре не действует на алюминий.
Мышьяковая кислота (H3AsO4) и окись мышьяка сильно разрушают алюминий, а мышьяковистая кислота (H3AsO3) без нагревания на него не влияет.
Азотистая кислота (HNO2) при комнатной температуре не действует на алюминий.
Азотная кислота (HNO3) воздействует на алюминий по-разному, в зависимости от концентрации. Разбавленные растворы интенсивно разрушают алюминий. В концентрированных растворах вследствие окислительных процессов поверхность алюминия пассивируется и коррозия замедляется. Наиболее сильную коррозию вызывает кислота концентрацией 10-60%. Действие азотной кислоты приводит к равномерной коррозии. С увеличением чистоты алюминия возрастает его стойкость к коррозии. Наличие в составе слава примесей меди, кремния, магния усиливает воздействие азотной кислоты.
Клей и сода
Это необычное, но высокоэффективное соединение поможет избавиться от въевшейся грязи. Такая субстанция имеет влагоотталкивающие характеристики, что значительно упрощает процесс. Всё проходит по следующей системе:
- в специальную тару заливается 10 л кипятка;
- добавляется по 100 гр каждого элемента;
- подготовленную вещь погружают в бадью на 3 часа;
- по прошествии времени остатки смываются мылом и вытираются тряпочкой.
Очистка посуды при помощи соды
Такое соединение не отнимет много сил, а канцелярский клей вступая в термическую реакцию не выделяет вредных испарений. Поэтому он хорошо подойдёт как для обработки промышленных, так и других изделий.
Свойства
Давайте изучим характеристики алюминия. Описываемый металл плавится при температуре 659 градусов Цельсия. Плотность вещества составляет 2,69*103 кг/см3. Алюминий относят в группу активных металлов. Устойчивость к коррозионным процессам зависит от ряда факторов:
Чистота сплава. Для производства различного оборудования берут металл, отличающейся своей чистотой. В нем не должно быть различных примесей. Широко распространен алюминий марки АИ1, а также АВ2. Среда, в которой находится алюминий. Какая концентрация примесей в окружающей алюминий среде. Температура. Большое влияние оказывает рН среды. Нужно знать, что оксид алюминия может образовываться, когда рН находится в интервале между 3 и 9. В той среде, где на поверхности листа алюминия сразу же появляется оксидная пленка, коррозионные процессы развиваться не будут. Вам будет интересно: Что такое «патриции»? Исторические сведения
Сплавы других металлов подвержены появлению ржавчины. Она проявляется достаточно быстро. Если создать для алюминия определенные условия, то он не будет разрушаться долгие годы. Для защиты алюминия от коррозии на нем образуется специальная пленка. Она ложится тонким слоем, который составляет от 5 до 10 миллиметров. Состоит подобное покрытие из оксида алюминия.
Пленка является прочной и дает металлу дополнительную защиту от внешних негативных воздействий. Благодаря такому слою воздух и влага не попадают в структуру материала. Если целостность оксидного покрытия нарушается, то начинается процесс коррозии алюминия. Металл теряет свои свойства.
Вам будет интересно: Альтернативность — это наличие выбора возможностей
Когда встает вопрос о том, ржавеет ли алюминий, необходимо задуматься о причинах, приводящих к коррозии. Различные внешние факторы могут ускорять этот процесс. Причины появления ржавчины на алюминии могут быть следующими:
Взаимодействие с какой-либо кислотой или щелочью. Механическое давление. Например, трение или сильный удар, после чего появляется царапина на верхнем слое металла. Существуют промышленные районы. В них продукты распада топлива влияют на оксидную пленку и разрушают ее. Металл начинает портиться. Аналогичная ситуация происходит в мегаполисах, где продукты распада топлива будут взаимодействовать с серой, а также с оксидами углерода. Подобный процесс разрушает пленку на алюминии. После такого рода внешнего воздействия алюминий подвергается коррозии. Следует помнить, что хлор, фтор, а также бром и натрий могут растворить защитный слой металла. Если на металл попадают строительные смеси, то он начинает быстро портиться. В данном случае на алюминий неблагоприятно воздействует цемент. Ржавеет ли алюминий от воды? Если она попадает на лист, то металл может быть подвержен коррозионным процессам
Важно при этом уточнить, какая жидкость оказывает воздействие. Многие используют специальный сплав, который не подвержен коррозии от воды
Его называют дюралюминием. Уникальный сплав используют вместе с медью, а также с марганцем.
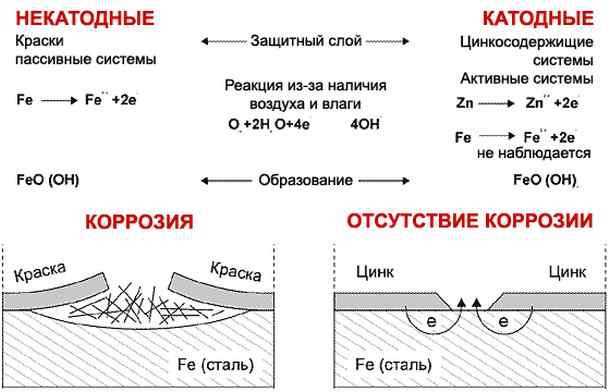
Чаще всего появление электрохимической коррозии провоцируют гальванические пары. Повреждение появляется в месте соединения двух разных сплавов. В таком случае ржавчина будет явно бросаться в глаза. Важным моментом является то, что портится только один металл, а второй является источником запуска коррозионного процесса. Чтобы не бояться электрохимической коррозии, нужно использовать магниевый сплав. Специалисты из-за электрохимической ржавчины не рекомендуют использовать обычное железо при контакте с кузовом из алюминия.
Существует ряд факторов, которые замедляют процессы коррозии алюминия, а некоторые из них останавливают подобное явление. Выделяют следующие:
Чтобы свойства алюминия, препятствующие коррозии, сохранялись, необходимо поддерживать кислотно-щелочной баланс. Диапазон должен составлять от шести до восьми единиц. Считается, что чистый металл, без примесей, лучше противостоит агрессивной среде. Учеными были проведены эксперименты. По результатам можно сказать, сплавы чистого алюминия (90%) подвержены коррозии больше, чем сплав, содержащий 99% этого вещества. У первого варианта коррозия наступает в 80 раз быстрее, чем у второго сплава. Чтобы в агрессивной среде металл дольше не терял свои свойства, его обрабатывают специальной краской. Можно использовать полимерный состав. После обработки появляется дополнительный защитный слой.
Коррозия алюминия и его сплавов с цинком
Ржавеет Al, как уже упоминалось, медленнее, чем его сплавы. Касается это в том числе и материалов группы Al-Zn. Такие сплавы очень востребованы, к примеру, в самолетостроении. Некоторые их разновидности могут содержать медь, другие нет. При этом первый тип сплавов, конечно же, является к коррозии более устойчивым. В этом плане материалы Al-Zn сравнимы с магниево-алюминиевыми.
Сплавы этой разновидности с добавлением меди проявляют признаки некоторой неустойчивости к ржавлению. Но при этом разрушаются из-за коррозии они все же медленнее, чем изготовленные с использованием магния и Cu.

Как очистить алюминий от окиси в домашних условиях
Алюминий подвержен окислению. При эксплуатации изделий слой окисла растет, что приводит к появлению темных пятен, которые покрывают всю поверхность или отдельные детали.
Чистить окись и черноту можно дома доступными народными средствами:
- Сода. Растворите средство в небольшом количестве воды для получения кашицы. Нанесите смесь на пятно и обработайте поверхность круговыми движениями.
- «Кока-Кола». Залейте предмет газировкой и через 1,5 часа вымойте его водой.
- Щавель. В емкость, требующую очистки, выложите пучок свежего щавеля и залейте водой. Поставьте посуду на плиту и прокипятите смесь на слабом огне 30 минут. Слейте раствор и прополощите изделие.
- Лимонная кислота. В кастрюле соедините 2 ст. л. лимонной кислоты и 1 л воды. Прокипятите раствор 15-25 минут в зависимости от степени загрязнения, а затем вымойте емкость чистой водой.
- Яблоко. Натрите потемневший окисленный след половинкой фрукта и оставьте на полчаса, чтобы яблочная кислота подействовала. По истечении времени вымойте емкость моющим средством.
Пищевая сода эффективно борется с окислом и темными пятнами на алюминиевых поверхностях. Продукт подходит для локального применения или масштабной чистки крупногабаритных изделий
Горчичный порошок, уксус и соль
Для удаления черноты с наружных стенок изделия приготовьте смесь из равных частей поваренной соли, уксуса и сухого горчичного порошка. Перемешайте компоненты до однородной консистенции. При помощи губки нанесите смесь на загрязнения и через 15 минут смойте теплой водой.
Поваренная соль
Для очистки алюминия соедините 2 ст. л. соли и 1 ч. л. теплой воды. Смешайте компоненты и нанесите на губку. Вотрите смесь в место загрязнения, оставьте на полчаса, а затем вымойте кастрюлю.
Солевой раствор – безопасное средство для чистки алюминия, которое расщепляет загрязнения, выводит черноту и помогает справиться с нагаром
Кислоты
Для очистки алюминиевых изделий используйте продукты, содержащие натуральные кислоты: кефир, лимонный сок, простоквашу, огуречный рассол. Залейте выбранным средством емкость или деталь и оставьте на ночь. Утром прополощите изделие и вытрите насухо.
Избавиться от значительного почернения помогут очищающие средства на основе щавелевой кислоты. Нанесите препарат на поверхность, выждите время, указанное на упаковке, а затем смойте водой.
Винный камень
Оттереть потемнения можно при помощи винного камня. Для проведения чистки в 5 л теплой воды растворите 3 ст. л. средства и в полученном растворе замочите изделие на 2-3 часа. Удалите остатки грязи мягкой губкой, прополощите теплой водой и вытрите насухо.
Потемнения, грязные подтеки, нагар и прочие загрязнения портят эстетический вид алюминиевых изделий. Справиться с проблемами можно в домашних условиях, используя народные средства или специальную бытовую химию
Виды оксидирования

Сегодня используется большое количество видов. Они представлены следующими категориями:
Анодное оксидирование
Этот вид является достаточно распространенным. Он представляет собой образование на металле оксидной пленки для предотвращения появления коррозии методом их поляризации их анодов в среде, которая создается при помощи подключения электрического тока. Данный метод применяется для таких металлов, как алюминий, магний, титан.
Микродуговое оксидирование
Данная процедура заключается в том, что оксиды многих метало, которые были получены методом электрохимического окисления, подвергаются химической модификации с использованием электрического тока. Благодаря периодически возникающим электрическим импульсам на поверхности металлов появляется плотная пленка, которая служит надежной защитой от появления коррозии. Данная процедура носит еще одно название плазменно-электролитическое оксидирование. Оно используется лишь на небольшом количестве предприятий.
Холодное оксидирование
Эта процедура применяется только по отношению к стальным материалам разного типа. Ее еще называют чернением.
Щелочное оксидирование
 Сегодня не редко для обработки металлов используется щелочная среда. Для проведения данного процесса идеально подходят поверхности из стали. Технология проведения щелочного оксидирования предусматривает изготовление щелочной среды для того, чтобы при взаимодействии с металлом на его поверхности в результате взаимодействия образовалась оксидная пленка.
Сегодня не редко для обработки металлов используется щелочная среда. Для проведения данного процесса идеально подходят поверхности из стали. Технология проведения щелочного оксидирования предусматривает изготовление щелочной среды для того, чтобы при взаимодействии с металлом на его поверхности в результате взаимодействия образовалась оксидная пленка.
Низкотемпературное оксидирование
Данный вид процесса образования оксидной пленки является нейтральным. В процесс используется метод нагревания до невысоких температур, что обеспечивает покрытие металла слабой оксидной пленкой.
Электрохимическое оксидирование
Этой процедуре подвергаются разные виды металлов. Металлы погружаются в среду электролита.
Таблица 2. Составы растворов для декапирования.
| Декапирование алюминия и его сплавов | Температура | Время обработки |
| Состав 1 : | ||
| Азотная кислота 10-15% раствор (по объему) | 20°С | 5-15 с |
Таблица 3. Составы растворов для окрашивания алюминия в черный цвет.
| Для окрашивания в черный цвет: | г/л (воды) | Температура и время обработки |
| Состав 1: | ||
| Молибдат аммония = молибденовокислый аммоний = ammonium molybdate = парамолибдат аммония= (NH4)6Mo7O24 | 10-20 | 90-100°С / 2-10 мин |
| Хлорид аммония = хлористый аммоний = NH4Cl | 5- 15 |
Таблица 4. Составы растворов для окрашивания алюминия в серый цвет.
| Для окрашивания в серый цвет: | г/л (воды) | Температура и время обработки |
| Состав 1: | ||
| Оксид мышьяка (III) = триокись мышьяка = трехокись мышьяка = arsenic trioxide As2O3 | 70-75 | Кипение / 1-2 мин |
| Кальцинированная сода = карбонат натрия = натрий углекислый . Химическая формула, Na2CO3 | 70-75 |
Таблица 5. Составы растворов для окрашивания алюминия в зеленый цвет.
| Для окрашивания в зеленый цвет: | г/л (воды) | Температура и время обработки |
| Состав 1: | ||
| Ортофосфорная кислота | 40-50 | 20-40°С / 5-7 мин |
| Кислый фтористый калий = калий бифторид = калий гидрофорид = kalium bifluoratum = potassium bifluoride = kaliumbifluorid = KHF2 | 3-5 | |
| Хромовый ангидрид = оксид хрома(VI) = трёхокись хрома = CrO3 (весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы) | 5-7 |
Таблица 6. Составы растворов для окрашивания алюминия в оранжевый цвет.
| Для окрашивания в оранжевый цвет: | г/л (воды) | Температура и время обработки |
| Состав 1: | ||
| Хромовый ангидрид = оксид хрома(VI) = трёхокись хрома = CrO3 (весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы) | 3-5 | 20-40°С / 8-10 мин |
| Фторсиликат натрия = кремнефтористый натрий = Na2SiF6 | 3-5 |
Как удалить свежее загрязнение
Если слой краски нанесен недавно, нет необходимости использовать химические средства. Достаточно смочить губку в теплой воде и промыть поверхность. Для очистки кистей после работы следует оставить их в воде на 15 минут, а затем подержать под напором воды. Когда загрязнение свежее, но попало на поверхность, в которую быстро въедается, потребуется применить дополнительные средства.
Подсолнечное масло и хозяйственное мыло
Смыть с одежды даже свежие пятна краски очень сложно, и результат напрямую зависит от типа ткани. Сразу после попадания вещества на одежду необходимо обработать участок подсолнечным маслом и замочить на 15 минут в горячей воде, предварительно натерев хозяйственным мылом. После вымачивания следует постирать одежду в стиральной машинке или вручную.
Уайт-спирит
С большинства тканевых поверхностей удалить пятна краски можно при помощи вещества уайт-спирит. Чтобы оттереть краску растворителем, необходимо нанести небольшое количество на тряпку или губку и аккуратно провести по загрязнению.
Изопропиловый спирт
Изопропиловый спирт является растворителем органического происхождения. Чтобы убрать загрязнение с поверхности, необходимо нанести спирт и через несколько минут смыть его. Если краска начала въедаться, стоит воспользоваться жесткой губкой.
Жидкость для снятия лака
Смывать акриловую краску с одежды или тканевой поверхности можно жидкостью для снятия лака, в составе которой отсутствует ацетон
Это важно для сохранения структуры и цвета материала. Жидкость для снятия лака эффективно устраняет только свежие пятна
Нашатырный спирт и уксус
В случаях, когда отстирать краску другими способами не получается, можно использовать уксус и нашатырный спирт. Достаточно вымочить ватный диск или мягкую тряпку в растворах, а затем обрабатывать пятно до его полного исчезновения.
Лак для волос
Нанесение лака для волос на свежую акриловую краску влияет на ее структуру и позволяет легко смыть. От воздействия лака состав отслаивается, и достаточно обработать поверхность тряпкой или губкой.
Защита алюминия от коррозии (видео)

Алюминий – широко распространенный в промышленности и быту металл. Окисление алюминия на воздухе не происходит. Его инертность обусловлена тонкой оксидной пленкой, защищающей его. Однако под влиянием определенных факторов из окружающей среды этот метал все же подвергается разрушительным процессам, и коррозия алюминия — не такое уж и редкое явление.
Коррозионная стойкость алюминия
Окись алюминия создает защитный слой, толщина которого составляет 20—100Å, который химически инертен. Чистый алюминий, с поверхностью, очищенной от защитной пленки, реагирует с водой, выделяя при этом водород и создавая оксидную пленку на поверхности.
Таким образом, при контакте с окислителями, поверхность алюминия пассивируется. По сути, кислород, содержащийся в воздухе или растворенный в воде, повышает коррозионную стойкость алюминия, которая, в свою очередь, в значительной степени зависит от содержания примесей других металлов.
Известно, что при контакте двух металлов, в среде электролита, образуется гальваническая пара, где анодом становится более активный металл, а катодом — менее активный. В результате электрохимической реакции происходит разрушение структуры анода. Большая часть примесей (железо, свинец, медь и т.д.
) играют по отношению к алюминию роль катода, способствуя его разрушению. По этой причине чистый алюминий имеет более высокую стойкость к коррозии, чем технический, который, в свою очередь, более стоек к коррозии, чем сплавы алюминия с другими металлами.
Рис.2. Механизм образования оксидной пленки на алюминии
Заключение
Алюминий имеет высокую стойкость к коррозии, однако, при контакте с другими металлами или при воздействии электрического тока подвержен коррозии. Мерами по защите алюминиевых светопрозрачных конструкций от коррозии являются нанесение порошкового покрытия или анодирование, а так же использование нержавеющего или оцинкованного крепежа и элементов конструкции.